Determinação Experimental da Tensão Superficial de Líqüidos Puros
Aderjane F. Lacerda, Luciana P. Santos,
Sílvia M. A. de Andrade e Moilton R. Franco Jr
Universidade Federal De Uberlândia -
Faculdade De Engenharia Química
RESUMO - Este trabalho visa construir um equipamento e realizar um experimento simples, em laboratório, com a finalidade de determinar a tensão superficial de líquidos puros (ou misturas), utilizando o método da gota. O experimento e a redação do roteiro para sua execução fez parte dos requisitos de avaliação de alunos de pós-graduação em Engenharia Química. A idéia do trabalho é promover o contato do futuro mestre com o laboratório didático além de proporcionar um começo ao estudo do efeito de adição de surfactantes na tensão superficial de fluidos
I – Introdução
Muitas mudanças ocorrem na superfície dos líquidos e sólidos, pois é onde ocorrem a vaporização e a condensação, porém pouco se percebe os eventos que ali ocorrem. Entretanto, a superfície de um líquido tem propriedades interessantes por si mesmas, incluindo a tensão superficial, e ver-se-á como a forma de uma superfície afeta o comportamento de um líquido. Essas propriedades são modificadas se um soluto está presente, particularmente, e se o mesmo é um agente ativo na superfície, daí a importância de se descrever termodinamicamente e explorá-lo experimentalmente. Efeitos superficiais também afetam profundamente as propriedades de colóides, particularmente suas estabilidades.
Processos que ocorrem nas superfícies determinam muitos aspectos diários, incluindo a própria vida. Camadas de moléculas nas superfícies líquidas são usadas para reduzir a taxa de evaporação de água em regiões áridas e para estabilizar espumas, e suas propriedades são importantes quando se consideram as propriedades e o tratamento de poluentes, como nos derramamentos de óleo no mar.
Ao se aplicar uma força normal à superfície do líquido, este tende a aumentar de área, porém, têm-se a impressão de que a superfície do líquido é constituída de uma membrana a qual impede este aumento de área. O efeito desta "membrana" é conseqüência direta das forças de atração para o interior do líquido, chamadas forças de van der Waals, e que são sentidas pelas moléculas da superfície. A esta força que se opõe ao aumento da área do líquido foi dado o nome de tensão superficial. Assim, quanto maiores as forças de coesão entre as moléculas de um líquido, maior será a sua tensão superficial.
Líquidos tendem a adotar formas que minimizam sua área superficial, pois então um maior número de moléculas encontram-se em seu volume e dessa forma permanecem cercadas por outras moléculas. Gotas de líquidos, portanto, tendem a ser esféricas, porque uma esfera é a forma com a menor razão superfície/volume. Entretanto, pode haver outras forças presentes que competem contra a tendência de assumir essa forma ideal e, em particular, a gravidade pode achatar essas esferas em poças ou oceanos.
Efeitos de superfície podem ser expressos na linguagem de energias de Helmholtz e Gibbs. A ligação entre essas quantidades e a área superficial é o trabalho necessário para mudar a área por uma quantidade dada, e o fato de que dA e dG são iguais (sob condições diferentes) ao trabalho feito ao mudar a energia do sistema. O trabalho necessário para mudar a área superficial q de uma amostra por uma quantidade infinitesimal dq é proporcional a dq, têm-se, portanto:
dw = g.dq (I.1)
O coeficiente g é chamado de tensão superficial; suas dimensões são energia/área (J.m-2). Entretanto, os valores de g costumam ser apresentados em Newtons por metro (N.m-1, porque 1J = 1 N.m). A volume e temperatura constantes, o trabalho de formação da superfície pode ser identificado com a mudança da energia de Helmholtz, e pode-se escrever:
dA = g.dq (I.2)
Uma vez que a energia de Helmholtz decresce (dA ® 0) e se a área superficial decresce (dq ® 0), as superfícies têm uma tendência natural a se contrair. Este é um modo mais formal de expressar o que já havia sido descrito.
Uma superfície líquida geralmente não é achatada. O efeito da tensão superficial é minimizar a área superficial, resultando na formação de uma superfície curva, como em uma bolha. Pode-se agora ver que há duas conseqüências da curvatura e, portanto, da tensão superficial, que são relevantes para as propriedades dos líquidos. Uma é que a pressão de vapor de um líquido depende da curvatura de sua superfície. A outra é a ascensão (ou descida) capilar de líquidos em tubos estreitos.
Observe que a tensão superficial não é nenhuma força ou interação nova, com o mesmo status do peso ou da força elétrica. É apenas um tipo de equilíbrio entre essas forças que já existem no líquido moldando a forma da superfície desse líquido.
A intensidade dessa tensão depende do líquido que será tratado, da pureza e temperatura em que se encontra. Alguns aditivos modificam fortemente a tensão superficial de um líquido. O exemplo mais comum é o dos detergentes que diminuem muito a tensão superficial da água em que são dissolvidos. Com isso, diminui-se a tendência de formar gotas, fazendo com que as moléculas da água tenham maior contato com as fibras dos tecidos. Dessa forma, a sujeira do tecido é mais facilmente deslocada pela água e dissolvida em forma de emulsão.
II – Aparelhagem
O equipamento experimental está apresentado na Figura 1, que se segue, e consta, basicamente, de uma bureta automática composta de dois reservatórios de 10 ml providos de êmbolos. Na extremidade do êmbolo, um capilar é conectado e fixado no interior de uma balança analítica onde um bécker se encontra no prato da balança para receber as gotas. O líquido é colocado dentro do reservatório, o sistema de bombeamento é ligado e o cronômetro é disparado. Dados de massa da gota em função do tempo são coletados.
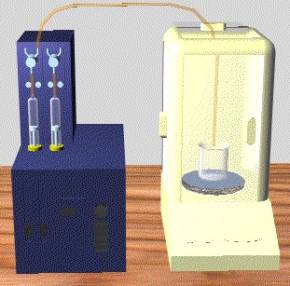
Figura 1 – Equipamento experimental para determinação da tensão superficial pelo método da gota.
Materiais utilizados no experimento:
· Bureta automática; capilares de diferentes diâmetros;
· Balança analítica com precisão de 0,0001g;
· Beckeres; Água ( e outros fluidos)
· Cronômetro.
III – Execução do ensaio
III.1 – Princípio do método
O método da gota é, talvez, o mais convenientemente correto para se medir a tensão superficial de um gás-líquido ou líquido-líquido (interface). O procedimento é formar gotas do líquido no fim de um tubo, permitindo a queda dentro de um recipiente até que o suficiente tenha sido coletado, assim o peso da gota pode ser determinado corretamente.
Esse método é muito antigo, com observações feitas por Tate (1864), e uma simples expressão para o peso da gota é encontrado pela fórmula abaixo:
W = 2prg (IV.1)
Na prática, o peso W é obtido, o qual é menor do que o valor W ideal. A razão para isto vir a ser evidente quando o processo da formação da gota é observado hermeticamente. As pequenas gotas surgem a partir da instabilidade mecânica da superfície cilíndrica do gargalo que desenvolve; em qualquer evento, isto é claro que somente uma porção da gota atinge o ponto de instabilidade atualmente – acima de 40% do líquido pode ficar preso na extremidade.
O procedimento usual é para aplicar um fator de correção ‘f ’ na equação anterior, assim que W’ é encontrado por:
W’ = 2prgf (IV.2)
Harkins e Brown concluíram que ‘f ’ mostrado será uma função da razão r/a ou r/V1/3 , onde V é o volume da gota. Isto foi verificado, experimentalmente, determinando pesos das gotas de água e benzeno, usando capilares de vários raios. Sabendo os valores de g a partir de medidas do capilar, e daí os respectivos valores de ‘a’, ‘f ’ pode ser determinado neste caso. A variação do resultado de ‘f ’ com r/V1/3 está na Tabela 4 (em anexo).
Isto é conveniente para usar r/V1/3 com valores na região de 0,6 a 1,2; onde ‘f’ é variado mais lentamente. A tabela é usada a seguir. Partindo de valores experimen-tais de ‘m’, a massa da gota, o volume da gota V é determinado a partir da densidade do líquido, e r/V1/3 é avaliado. A partir da tabela, o valor correspondente de ‘f ’ é determinado e, então, o valor correto para a tensão superficial é encontrado por:
g = mg/2prf (IV.3)
Percebeu-se que não é somente uma grande correção, para uma dada extremidade radial, isto depende da natureza do líquido. Por isso, é incorreto assumir que o peso da gota para dois líquidos é a razão das respectivas tensões superficiais quando a mesma medida da extremidade é usada. Finalmente, os fatores de correção para r/V1/3 < 0,3 tem sido determinado usando gotas de mercúrio.
O método da gota pode ser usado para a determinação das tensões interfaciais líquido-líquido. A mesma equação é aplicada, todavia, deve ser relembrado que W’ e ‘m’ agora denotam o peso e a massa da gota menor do que o líquido deslocado. Também a validade da Tabela 4 não é inteiramente estabilizada e correta se os fluidos forem viscosos.
III.2 – Procedimento experimental
· Colocar a bureta automática ao lado de uma balança analítica, com precisão de 0,0001g;
· Encher os êmbolos da bureta, com a substância a ser analisada;
· Inserir um bécker seco (200 mL) na balança e zerar a mesma;
· Inserir os capilares da bureta, pela parte superior da balança, de modo que a substância possa cair dentro do bécker;
· Ajustar a bureta, de preferência, na vazão de 0,25 cm3/min; Outras vazões foram testadas para se escolher aquela de projeto.
· Iniciar o experimento, medindo-se o intervalo de tempo, desde a formação da gota até o desprendimento da mesma, verificando, simultaneamente, sua massa;
· Realizar uma média de, no mínimo, 50 pontos.
IV – Resultados
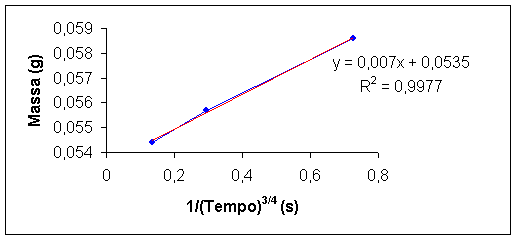
Os dados experimentais de massa e tempo foram representados em um gráfico, Figura 2 (em anexo), e obtida assim a equação da reta, para posteriormente se determinar a tensão superficial da água.
IV.1 – Expressão do resultado
= 0,007.s + 0,0535 (IV.1)
onde:
mt = massa total;
meq = massa de equilíbrio;
s = inclinação da reta;
t = tempo total.
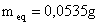
Dados:
Diâmetro do capilar ( D ) = 0,3 cm
Raio do capilar ( r ) = 0,15 cm
Densidade da água ( d ) = 1 g/cm3
Volume da gota = Vg
(IV.2)
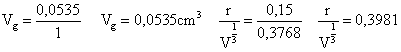
(IV.3)
Fazendo interpolação obteve-se o seguinte valor de ‘f ’:
f = 0,6835
Substituindo os valores encontrados na Equação (IV.3):
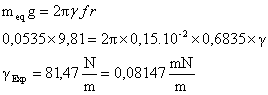
gliteratura = 0,072 mN
m
Desvio Relativo = 0,0815 – 0,072 x 100 = 13,2%
0,072
Desvio Padrão = 0,006718
V – CONCLUSÃO
A regra de Tate pode ser usada para determinar a tensão superficial de um líquido dentro de uma tolerância razoável, devido a simplicidade do método. O procedimento é simples e requer um operador hábil para se obter bons resultados.
VI - Referências Bibliográficas
MATTHEWS, D. J. H.; BENDER, P.; ALBERTY, R. A.; Experimental Physical Chemistry,5th ed.; McGraw-Hill Book Co. 1956.
ADAMSON, Arthur W.; Physical Chemistry of Surfaces; 4th ed.; Wiley – Interscience.
ATKINS, Physical Chemistry, 5th ed., Oxford University Press,Oxford, 1994.
CASTELLAN,G.W.; Físico-Química, vol.1,2th ed.; LTC editora S.A.,1982.
VII - Anexos
Tabela 1 – Resultados obtidos no experimento com vazão de 0,25 cm3/s
Experimento
Massa da gota (g)
Tempo de queda (s)
Experimento
Massa da gota (g)
Tempo de queda (s)
01
0,0544
13”96
26
0,0536
14”26
02
0,0526
14”51
27
0,0538
14”35
03
0,0521
14”20
28
0,0556
14”30
04
0,0553
14”27
29
0,0549
14”28
05
0,0538
14”25
30
0,0527
14”48
06
0,0537
14”05
31
0,0551
14”55
07
0,0546
13”99
32
0,0532
14”69
08
0,0527
14”46
33
0,0548
14”19
09
0,0533
14”41
34
0,0541
13”95
10
0,0557
13”99
35
0,0562
14”09
11
0,0536
13”99
36
0,0557
14”25
12
0,0546
14”61
37
0,0543
14”58
13
0,0535
14”28
38
0,0561
14”69
14
0,0530
14”44
39
0,0529
14”03
15
0,0561
14”44
40
0,0537
13”79
16
0,0546
14”58
41
0,0548
14”54
17
0,0550
14”07
42
0,0555
14”60
18
0,0556
14”03
43
0,0526
14”55
19
0,0524
14”06
44
0,0533
13”97
20
0,0567
14”19
45
0,0547
14”60
21
0,0545
14”30
46
0,0560
14”26
22
0,0560
13”77
47
0,0553
14”09
23
0,0538
13”88
48
0,0549
14”43
24
0,0569
13”89
49
0,0538
13”92
25
0,0542
14”26
50
0,0564
14”35
Massa média = 0,0544 g Tempo médio = 14”25 s Desvio Padrão = 0,001235
Tabela 2 – Resultados obtidos no experimento com vazão de 0,75 cm3/s
Experimento
M. gota (g)
Tq (s)
Experimento
M. gota (g)
Tq(s)
01
0,0573
5”08
26
0,0587
5”09
02
0,0549
4”98
27
0,0572
5”26
03
0,0399
5”19
28
0,0380
4”97
04
0,0572
5”43
29
0,0528
5”35
05
0,0466
5”19
30
0,0584
5”30
06
0,0593
4”97
31
0,0561
5”13
07
0,0561
4”82
32
0,0558
5”29
08
0,0554
5”49
33
0,0585
5”22
09
0,0561
5”09
34
0,0592
5”29
10
0,0544
5”12
35
0,0573
5”16
11
0,0603
4”95
36
0,0544
5”24
12
0,0593
4”79
37
0,0545
5”30
13
0,0585
4”79
38
0,0599
5”06
14
0,0603
5”29
39
0,0568
4”90
15
0,0587
5”23
40
0,0579
4”91
16
0,0559
4”94
41
0,0597
5”40
17
0,0374
5”26
42
0,0552
5”09
18
0,0552
5”22
43
0,0453
5”12
19
0,0595
5”10
44
0,0594
5”13
20
0,0581
5”17
45
0,0591
5”09
21
0,0585
5”13
46
0,0584
5”24
22
0,0552
5”24
47
0,0574
5”17
23
0,0576
4”84
48
0,0580
5”24
24
0,0586
5”13
49
0,0570
5”28
25
0,0514
5”26
50
0,0564
4”98
Massa média = 0,0557 g Tempo médio = 5”14 s Desvio Padrão = 0,0053
Tabela 3 – Resultados obtidos no experimento com vazão de 2,5 cm3/s
Experimento
M gota (g)
Tq (s)
Experimento
M gota (g)
Tq (s)
01
0,0583
1”36
26
0,0587
1”52
02
0,0589
1”36
27
0,0572
1”35
03
0,0579
1”43
28
0,0580
1”57
04
0,0588
1”72
29
0,0608
1”53
05
0,0576
1”57
30
0,0584
1”56
06
0,0593
1”56
31
0,0591
1”34
07
0,0581
1”59
32
0,0598
1”58
08
0,0594
1”43
33
0,0585
1”53
09
0,0591
1”49
34
0,0592
1”59
10
0,0584
1”90
35
0,0573
1”49
11
0,0603
1”62
36
0,0594
1”54
12
0,0593
1”41
37
0,0595
1”59
13
0,0585
1”60
38
0,0599
1”31
14
0,0603
1”49
39
0,0588
1”54
15
0,0587
1”53
40
0,0579
1”46
16
0,0579
1”63
41
0,0597
1”53
17
0,0574
1”60
42
0,0592
1”51
18
0,0582
1”49
43
0,0583
1”74
19
0,0595
1”45
44
0,0594
1”48
20
0,0581
1”43
45
0,0591
1”40
21
0,0585
1”70
46
0,0584
1”58
22
0,0582
1”53
47
0,0574
1”55
23
0,0576
1”47
48
0,0580
1”71
24
0,0586
1”61
49
0,0579
1”54
25
0,0594
1”52
50
0,0584
1”66
Massa média = 0,0586 g Tempo médio = 1”53 s Desvio Padrão = 0,00083
Tabela 4 – Fatores de correção para o método da gota ( Harkins e Brown)

r/V1/3
f
r/V1/3
f
r/V1/3
fa
0,00
(1,0000 )
0,75
0,6032
1,225
0,656
0,30
0,7256
0,80
0,6000
1,25
0,652
0,35
0,7011
0,85
0,5992
1,30
0,640
0,40
0,6828
0,90
0,5998
1,35
0,623
0,45
0,6669
0,95
0,6034
1,40
0,603
0,50
0,6515
1,00
0,6098
1,45
0,583
0,55
0,6362
1,05
0,6179
1,50
0,567
0,60
0,6250
1,10
0,6280
1,55
0,551
0,65
0,6171
1,15
0,6407
1,60
0,535
0,70
0,6093
1,20
0,6535
Obs: os valores de fa são menos corretos do que os outros
Fonte: ADAMSON (1982)
Figura 2 – Gráfico Massa da gôta x Tempo de queda para as vazões estudadas.