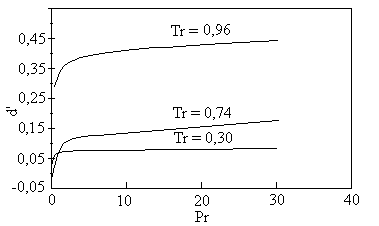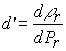São os Líquidos Incompressíveis? |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Luiz Roberto Terron Introdução Em várias situações práticas usuais da Engenharia Química os líquidos são considerados como incompressíveis, ou seja, a pressão não exerce influência no volume por eles ocupado; pode-se aumentar ou diminuir a pressão que a densidade permanecerá constante. Um exemplo dessa consideração é a simplificação que se faz na equação do balanço diferencial de massa para o caso de líquidos. A equação geral do referido balanço é (veja, por exemplo, o cap. 7 de Bennet e Myers, 1978):
Quando o
líquido é considerado incompressível, tanto para escoamento em regime estacionário ou
variável, a relação entre o volume ocupado pelo líquido e a sua massa, ou seja a
densidade do líquido é constante e o termo
que é bem mais simples de ser resolvida do que a equação (1). Mas para ser
adotada essa simplificação, deve-se antes verificar se é permitida pelas condições de
pressão e temperatura, na qual se encontra o líquido. A seguir, serão feitas algumas
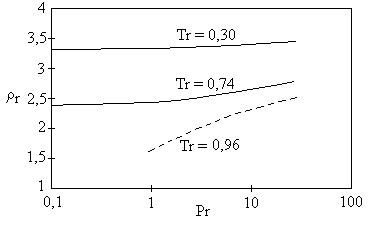
considerações sobre os efeitos da pressão na densidade do fluido. Efeitos da pressão na densidade de líquidos Os efeitos da pressão na densidade de líquidos podem ser observados no gráfico da figura 1, onde a densidade reduzida está disposta em função da pressão reduzida para alguns valores de temperatura. Esses dados (Hougen et alii, 1959) são válidos para compostos cujo fator de compressibilidade crítico é 0,27.
Fig. 1: Densidade reduzida de líquidos em função da Observando-se o gráfico da figura 1 nota-se que, para a temperatura reduzida mais baixa, Tr = 0,30, os valores da densidade reduzida são praticamente constantes em toda a faixa de pressões reduzidas. Isso não ocorre para os outros casos: quando Tr = 0,74, a faixa de pressões onde a densidade reduzida independe da pressão é bem menor do que no caso anterior. Para Tr = 096, essa faixa não existe. Isso quer dizer
que, quanto maior a temperatura de um líquido, maior será a influência da pressão na
sua compressibilidade, ou seja, com menos propriedade ele poderá ser considerado
incompressível. O gráfico da figura 2, que apresenta a derivada da densidade reduzida
com relação à pressão reduzida, Com dados de
densidade reduzida em função da pressão e da temperatura reduzidas pode-se estabelecer
critérios que permitem estabelecer até que valores de pressão pode-se considerar o
líquido como um fluido incompressível para uma dada temperatura reduzida. Tais dados
são, normalmente apresentados sob a forma de gráficos e tabelas, encontrados em vários
textos sobre Termodinâmica Química (veja por exemplo, Hougen et alii, 1959 e Daubert,
1985). A partir desses dados tem-se, para uma certa temperatura reduzida, uma determinada
pressão tal que, acima dela, os líquidos passam a experimentar variações
consideráveis na sua densidade reduzida, quando a pressão reduzida aumenta. Na figura 3
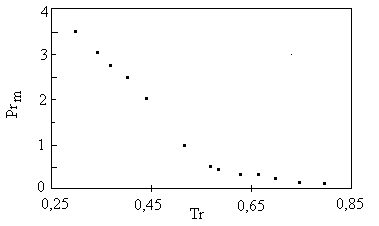
tem-se essa pressão limite, Prm, para a faixa de temperaturas reduzidas variando de 0,2 a
0,8. Para tr>0,8 não é recomendada a consideração de incompressibilidade de
líquidos em nenhuma pressão. Quando Tr<0,8, pode-se considerar a densidade do
líquido como sendo o valor no estado saturado, a Tr, até Pr < Prm. Figura 2: Derivada da densidade reduzida de líquidos em função da pressão reduzida para várias temperaturas ZC = 0,27
Figura 3: Pressão reduzida limite, Prm, em função da temperatura reduzida - zc = 0,27 Os dados da figura 3 podem ser correlacionados, originando a seguinte equação:
a qual se ajusta bem aos dados originais, como pode ser visto nas informações estatísticas apresentadas na tabelas 1 e 2. Tabela 1: Análise da regressão polinomial (equação 3)
Tabela 2: Análise da variança (equação 3)
Como usar os dados apresentados? Tanto os dados da figura 3 quanto a equação (3) podem ser usados para verificar se o líquido pode ser considerado incompressível, frente as condições de pressão e temperatura nas quais ele se encontra. A seguir serão dados dois exemplos de uso da equação (3) para essa verificação.
Tem-se etanol líquido a temperatura ambiente (25C) e 10 atm. Nessas condições, pode-se considerar o etanol como incompressível? Em primeiro lugar deve-se coletar dados das constantes críticas do etanol a partir de tabelas de propriedades existentes em livros textos de termodinâmica química (veja citações anteriores) ou em manuais especializados em propriedades das substâncias (veja, por exemplo, o "Appendix A" de Reid et al., 1987, o qual será usado na resolução deste exemplo). As propriedades do etanol (substância 170 na tabela do citado "Appendix A") são as seguintes: Tc = 513,9 K Pc = 61,4 bar = 63,0 atm a seguir calculam-se as propriedades reduzidas: Tr = T/Tc = (25+273,16)/513,9 = 0,58 Pr = P/Pc = 10/63 = 0,16 O próximo passo é verificar se a pressão de 10 atm está dentro do limite admissível para a consideração de incompressibilidade. Isto é feito calculando-se o valor de Prm para a temperatura de 25C, ou seja, para Tr = 0,58. Com a equação (3), tem-se que: Prm.(Tr = 0,58) = 0,32 Isto significa que, até uma presão reduzida igual a 0,32 (ou seja 210,16 atm) na temperatura reduzida de 0,58 (25C), o etanol poderá ser considerado como incompressível. Exemplo 2 Submetendo-se, agora, o etanol a uma temperatura igual a 150C, pode-se continuar considerando o etanol como incompressível? Para esse caso, a temperatura reduzida é: Tr = T/Tc = (150+273,16)/513,9 = 0,82 Com a
temperatura reduzida maior do que 0,8, não se pode considerar, de modo algum, o etanol
como incompressível. Conclusões Como pode ser visto, somente sob determinadas condições de pressão e temperatura, os líquidos podem ser considerados incompressíveis. Sabe-se (fig. 3) que, para Tr > 0,8, não é possível tal consideração. Quando Tr < 0,8, existe um valor limite da pressão reduzida, Prm, e, para valores dessa pressão inferiores a Prm, é posível a consideração da incompressibilidade. Prm é calculado através da equação (3). Quando as condições de pressão e temperatura permitem a consideração de incompressibilidade, o valor da densidade pode ser o da condição de saturação. Se não for
possível a consideração de incompressibilidade, deve-se recorrer a um modelo que
represente a densidade de líquidos subresfriados ou comprimidos, como, por exemplo, a
equação de Rackett ou a HBT (cfr. Reid et al., 1987, onde estão apresentados vários
modelos para o cálculo e representação da densidade de líquidos, saturados ou
comprimidos). Caso o líquido seja uma mistura, pode-se, ainda, utilizar as informações
anteriormente descritas desde que a temperatura reduzida seja calculada com uma
temperatura pseudo-crítica, calculada segundo modelos apresentados na literatura
(Reid...). Nomenclatura d’ derivada da densidade reduzida com relação a pressão reduzida ou F dimensão força P pressão - F/L2 (atm, bar, etc) Pc pressão crítica - F/L2 (atm, bar, etc) Pr pressão reduzida - adimensional (Pr=P/Pc) Prm pressão reduzida limite para consideração de incompressibilidade - adimensional T dimensão temperatura (K) Tc temperatura crítica (K) Tr temperatura reduzida - adimensional (Tr=T/Tc)) uk componente da velocidade na direção k (k=x,y,z) - L/ (m/s, cm/s etc.) vC volume molar crítica - L3/M (cm3/g, cm3/gmol, m3/kg, l/g, etc.) Zc fator de compressibilidade crítica - adimensional (Zc = Pc.vC/(RT)) Símbolos matemáticos
Letras gregas
Bennett, C. O; Myers, J. E. Fenômenos de transporte - Quantidade de Movimento, Calor e Massa, São Paulo, McGraw-Hill, 1978. Daubert, T. E. Chemical Engineering Thermodynamics, New York, McGraw-Hill, 1985. Hougen, O . A ., Watson, K. M., Ragatz, R. A. Chemical Process Principles. Part II Thermodynamics, 2nd edt., New York, Wiley, 1959. Reid, R. C., Pruusnitz, K. M., Sherwood, T. K. The Properties of Gases and Liquids, 3th edt., New York, McGraw Co., 1977. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
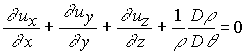 (1)
(1)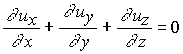 (2)
(2)